Covid-19 vakcīnu drošības monitorings – īpašs un pastiprināts
Eiropas Zāļu aģentūras (EZA) vadībā Covid-19 vakcīnu drošību ir izvērtējušas neatkarīgas starptautiskas ekspertu komandas, smaga un skrupuloza darba rezultātā atzīstot, ka to sniegtā aizsardzība gan pret saslimšanu, gan pret slimības smagākām un dzīvībai bīstamākām formām pilnībā atsver jebkādus iespējamos blakusparādību riskus. ES reģistrēto Covid-19 vakcīnu drošība un efektivitāte ir zinātniski pierādīta, jo tās izvērtētas klīniskajos pētījumos ar tūkstošiem respondentu un atbilst Eiropas Zāļu aģentūras zinātniskajiem drošības, efektivitātes un kvalitātes standartiem.
Turklāt ES reģistrēto Covid-19 vakcīnu drošību EZA skrupulozi izvērtē ne tikai pirms reģistrācijas, bet turpina to darīt arī pēc reģistrācijas.
Vairums Covid-19 vakcīnu ES ir izvērtētas centralizētās procedūras ietvaros. Vakcīnu izmantošana ES dalībvalstīs, tostarp Latvijā, tiek uzsākta tikai pēc reģistrācijas un pamatīgas kvalitātes kontroles, turklāt ikviena konkrētās vakcīnas sērija pirms izplatīšanas ES tiek rūpīgi un stingri testēta.
Covid-19 farmakovigilances (blakusparādību atklāšanas, izvērtēšanas un novēršanas) plāns nosaka, kā EZA un ES dalībvalstu atbildīgās nacionālās institūcijas nekavējoties identificē un izvērtē jebkuru jaunu ar šīm vakcīnām saistītu informāciju, ieskaitot ikvienu uz vakcīnas ieguvumu-risku līdzsvaru attiecināmu drošības signālu (informāciju par jaunu vai iepriekš zināmu blakusparādību, ko potenciāli varētu būt izraisījusi vakcīna un kam nepieciešama turpmāka izpēte). Lai nodrošinātu ātras un koordinētas atbildes uz jautājumiem, kas pandēmijas situācijā saistīti ar vakcīnu drošību, EZA ir izveidojusi multidisciplināru Covid-19 darba grupu, kurā apvienoti eksperti no visa Eiropas zāļu uzraudzības tīkla. Minētās iniciatīvas nodrošina iespēju identificēt ikvienu, pat iespējami retu, blakusparādību situācijā, kad vakcinēti miljoniem cilvēku.
Saskaņā ar ES likumdošanu vakcīnu drošības uzraudzība jāīsteno visu laiku, kamēr vien tās tiek izmantotas klīniskajā praksē. Parastā kārtība nosaka, ka kompānijām, kas ražo vakcīnas, reizi pusgadā jāsūta EZA drošības ziņojumi, taču attiecībā uz Covid-19 vakcīnām šī prakse ir mainīta – ziņojumu iesniegšanas regularitāte ir reizi mēnesī. Šis princips nodrošina to, ka EZA Farmakovigilances riska vērtēšanas komitejas īstenotais nepārtrauktais vakcīnu drošības izvērtējums ik mēnesi atspoguļo jaunākos drošības datus.
Covid-19 vakcīnas izpētes process nebija sasteigts
Iepriekš vakcīnu izpēte un attīstība patiešām noritēja ilgākā laika periodā, tomēr salīdzinoši ātrā Covid-19 vakcīnu izstrāde nenozīmē, ka drošības jautājumiem tika pievērsta mazāka uzmanība vai ka tie tika izvērtēti paviršāk.
Pirmkārt, Covid-19 vakcīnu izstrādē izmantotās tehnoloģijas ir pētītas un attīstītas jau gadiem ilgi – ar mērķi sagatavoties potenciāliem infekciju uzliesmojumiem. Tādējādi ražošanas procesi un tehnoloģijas bija pieejamas jau pašā pandēmijas sākumposmā. Turklāt dažas no Covid-19 vakcīnām tika izstrādātas, izmantojot ziņneša jeb informācijas RNS – iRNS (no angļu valodas mesendžera RNS – mRNS vai mRNA) tehnoloģijas, kas, salīdzinājumā ar ‘tradicionālajām’ vakcīnām, nodrošina ātrāku ražošanas procesu. [2]
Otrkārt, valstis dalījās ar SARS-CoV-2 vīrusa ģenētisko informāciju, tiklīdz tā bija pieejama, kas ļāva vakcīnas izstrādātājiem ļoti ātri uzsākt darbu pie vakcīnu izpētes un attīstības.
Treškārt, pateicoties daudzu valdību un organizāciju priekšfinansējumam, klīnisko pētījumu potenciālo dalībnieku lielajai atsaucībai, kā arī SARS-CoV-2 vīrusa augstajam lipīgumam un straujajai izplatībai pandēmijas apstākļos, vakcīnu ražotājiem bija iespēja īsākā laika posmā iegūt nepieciešamo datu apjomu, lai vērtētu vakcīnu efektivitāti un drošību, kā arī optimizētu izstrādes gaitu. Proti, Covid-19 vakcīnu izstrādē, izpētē un izvērtēšanā tika piesaistīti vēsturiski apjomīgākie zinātnes, finanšu un cilvēkresursi, kas iespējami īsā laika periodā nodrošināja kvalitatīvu vakcīnu izstrādi un pārbaudi atbilstoši nemainīgi stingrām reģistrācijas prasībām. [2]
Ceturtkārt, neatsverams bija arī EZA ieguldījums, vēl vakcīnu pirmsreģistrācijas posmā regulāri komunicējot ar vakcīnu izstrādātājiem un sniedzot tiem bezmaksas konsultācijas un padomus. Šis atbalsts nodrošināja to, ka veiktie pētījumi un iesniegtie dokumenti bija maksimāli kvalitatīvi, bet pats reģistrācijas process – iespējami ātrs un nevilcināts.
Blakusparādības – ne vienmēr vakcīnas izraisītas
Nopietnas vakcīnu drošības problēmas tiek novērotas ļoti reti. Ziņotie gadījumi attiecas uz indivīdu piedzīvotām iespējamām blakusparādībām, t.i., klīniskiem stāvokļiem, kas novēroti pēc vakcinācijas, bet ne vienmēr ir ar to saistīti vai tās izraisīti. Fakts, ka vienam vai otram indivīdam pēc vakcinācijas bijušas blakusparādības vai ārkārtīgi retos gadījumos iestājusies nāve, nebūt neliecina, ka cēlonis bijusi vakcinācija. Iemels var būt arī pilnībā ar vakcināciju nesaistīts – kāda blakus slimība, kopējais veselības stāvoklis vai vienlaikus lietota medikamenta iedarbība. [1]
EZA, veicot blakusparādību zinātnisko izvērtējumu, ņem vērā daudzus un dažādus faktorus, t.sk., pacienta slimību vēsturi, iespējamās blakusparādības biežumu vakcinētajā sabiedrības daļā, kā arī to, vai vispār ir bioloģiski iespējams, ka konkrētā vakcīna varētu izraisīt šādu reakciju.
Svarīgi saprast:
- Tikai detalizēts visu pieejamo datu izvērtējums sniedz pamatu drošticamiem secinājumiem par Covid-19 vakcīnu ieguvumu un risku attiecību;
- Katrs individuālais blakusparādību gadījums pilnībā attiecas tikai un vienīgi uz konkrēto indivīdu; katrā konkrētajā ziņojumā var tikt iekļauta informācija par vairākām blakusparādībām – tāpēc ziņoto blakusparādību gadījumu skaits var neatbilst indivīdu skaitam, kuri ziņojuši par blakusparādībām.
Secinājums visam iepriekš teiktajam ir viens – vairums vakcinācijas blakņu ir vieglas vai vidējas un īslaicīgas, savukārt nopietnas – ārkārtīgi retas, kurpretim ilgstošas un smagas sekas dabīgas izslimošanas gadījumā – ļoti reālas. Tāpēc atteikšanās no vakcinācijas, baidoties no iespējamām blakusparādībām, nav racionāli pamatota.
Līdz šā gada septembra beigām pilnībā vakcinēti ir 76% pieaugušo ES valstu iedzīvotāju, kopumā saņemot teju 563 miljonus vakcīnu devu, savukārt ziņoto iespējamo blakusparādību skaits – relatīvi niecīgs (skat. pievienoto tabulu). Šie skaitļi, manuprāt, runā ļoti skaidri un nepārprotami – vakcinācija ir drošs veids, kā pasargāt sevi un savus līdzcilvēkus pret Covid-19, un vakcinēšanos nevajag atlikt.
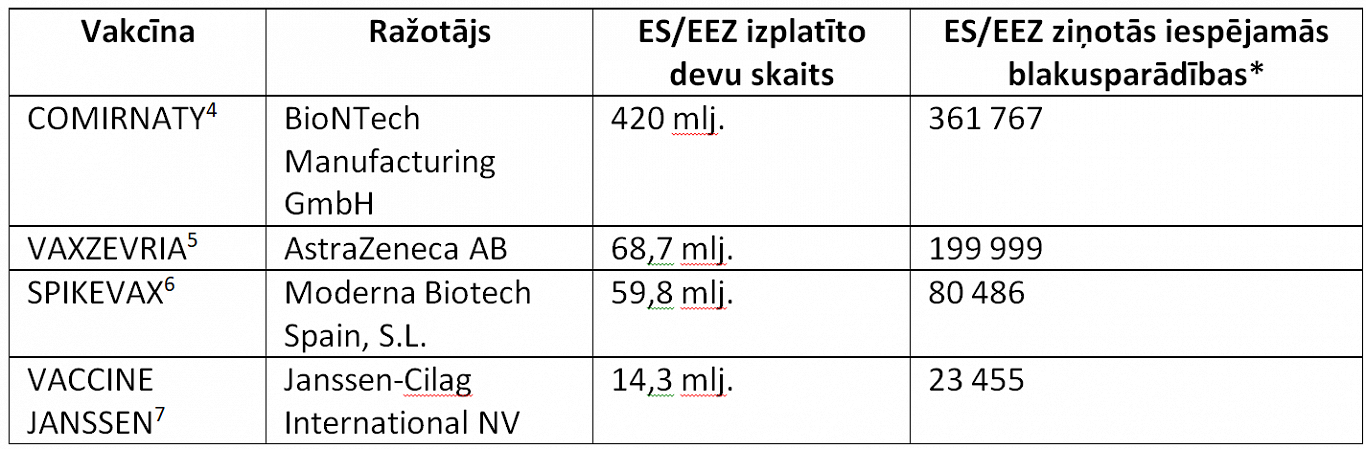
* Ziņotie gadījumi attiecas uz indivīdu piedzīvotām iespējamām blakusparādībām, t.i., klīniskiem stāvokļiem, kas novēroti pēc vakcinācijas, bet ne vienmēr ir ar to saistīti vai tās izraisīti. Katrā ziņojumā var tikt iekļauta informācija par vairākām blakusparādībām – tāpēc ziņoto blakusparādību gadījumu skaits var neatbilst indivīdu skaitam, kuri ziņojuši par blakusparādībām.
Vēres:
- https://www.ema.europa.eu/en/human-regulatory/overview/public-health-threats/coronavirus-disease-covid-19/treatments-vaccines/vaccines-covid-19/covid-19-vaccines-development-evaluation-approval-monitoring
- Johns Hopkins Coronavirus Resource Center, https://coronavirus.jhu.edu/map.html
- https://ec.europa.eu/info/live-work-travel-eu/coronavirus-response/safe-covid-19-vaccines-europeans_en
- https://www.ema.europa.eu/en/documents/covid-19-vaccine-safety-update/covid-19-vaccine-safety-update-comirnaty-6-october-2021_en.pdf
- https://www.ema.europa.eu/en/documents/covid-19-vaccine-safety-update/covid-19-vaccine-safety-update-vaxzevria-previously-covid-19-vaccine-astrazeneca-6-october-2021_en.pdf
- https://www.ema.europa.eu/en/documents/covid-19-vaccine-safety-update/covid-19-vaccine-safety-update-spikevax-previously-covid-19-vaccine-moderna-6-october-2021_en.pdf
- https://www.ema.europa.eu/en/documents/covid-19-vaccine-safety-update/covid-19-vaccine-safety-update-covid-19-vaccine-janssen-6-october-2021_en.pdf